南京中医药大学韩欣教授团队联合南京大学宋玉君教授、李喆教授和南京医科大学尹志强教授在Acta Pharmaceutica Sinica B(中科院1区, IF: 14.6)期刊上发表题为“Spatiotemporally delivery of Cas9 ribonucleoprotein/DNAzyme logic systems using near-infrared upconversion nanomachine for precise immunotherapy”的最新研究成果。
精准基因疗法是通过直接修改或调控致病基因,实现分子水平的疾病治疗技术。其核心在于利用基因编辑工具(如CRISPR-Cas9)、RNAi或基因替代疗法,针对特定基因突变、异常表达或功能缺陷进行修复、沉默或替换。近年来,结合多基因协同治疗、开发新型递送系统,是推动精准基因疗法临床转化的关键。基于此,韩欣教授课题组青年教师陈超开展了一系列工作(Signal Transduction and Targeted Therapy, 2020; Small, 2021, 2022; Nano Convergence, 2022; Acta Pharmaceutica Sinica B, 2023; Chemical Engineering Journal, 2023, 2024a b, 2025a)。针对上述问题,2022年Nature上发表的文章指出,DNAzyme能精确地对接到匹配的位置,它的催化核心切割RNA分子,所产生的RNA片段在细胞中迅速降解。然而,与传统DNAzyme系统相比,实现更精准地控制DNAzyme切割,以及实施不同层次的基因干扰极具挑战。
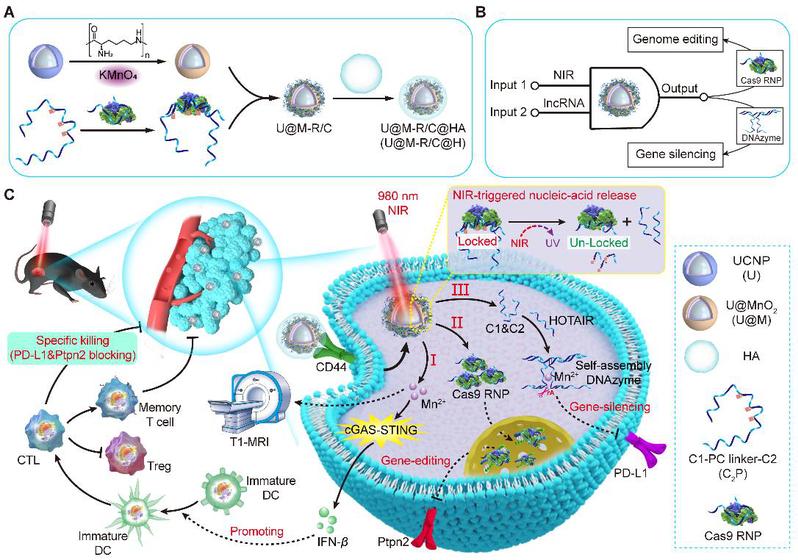
该研究构建了一种近红外光激活上转换纳米核酸药物用于递送Cas9 RNP/DNAzyme逻辑门系统为肿瘤精准基因疗法提供了新思路。此纳米药物以锰修饰的上转换纳米颗粒为核心,通过静电吸附搭载Cas9 RNP和DNAzyme逻辑系统,并在外层包裹透明质酸提升靶向性。其核心创新在于巧妙设计的光控双基因调控机制——近红外光(980 nm)触发下,纳米核酸药物释放Cas9 RNP精准编辑Ptpn2基因,同时利用内源性lncRNA(HOTAIR)自组装形成DNAzyme系统,特异性沉默PD-L1基因,实现免疫检查点的双重阻断。更关键的是,释放的Mn2+不仅能作为DNAzyme的催化辅助因子,还能激活cGAS-STING信号通路,并通过T1-MRI实现诊疗一体化。这一突破通过时空可控的基因编辑与免疫调控协同作用,为实体瘤系统性免疫治疗提供了高效低毒的新策略。
韩欣教授课题组青年教师陈超为第一作者,韩欣教授为该论文的责任通讯作者,南京中医药大学为第一通讯单位。该研究工作得到了国家自然科学基金项目(82302365、32471475)、南京中医药大学国家自然科学基金配套项目(XPT82302365)、长三角科技创新共同体联合攻关计划项目(2023CSJZN060)、中药制药过程控制与智能制造技术全国重点实验室创新项目(NZYSKL240201)、江苏省重点学科(生物学)、江苏省高校自然科学基金面上项目(23KJB310015)等项目资助。
原文连接:https://www.sciencedirect.com/science/article/pii/S2211383525004800
(撰稿人:陈超、韩欣;审核人:朱立峰)
