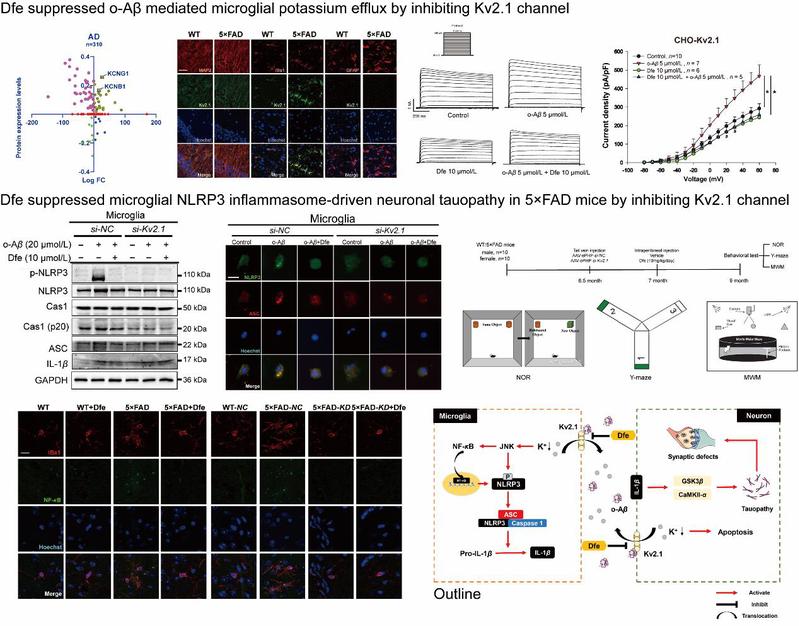
2024年11月,国际学术期刊Acta Pharmaceutica Sinica B (IF= 14.7) 在线发表了我校医学院沈旭和药学院曹鹏团队合作研究的最新成果。研究人员首次揭示了Kv2.1钾离子通道是淀粉样蛋白Aβ调控小胶质细胞炎症/神经元Tau过度磷酸化的桥梁,同时发现临床抗痉挛“老药”六氢芬宁 (Drofenine,Dfe) 作为Kv2.1抑制剂能够有效改善5×FAD模型鼠的阿尔兹海默症 (Alzheimer's disease, AD) 样病理症状。
AD是一种多发于老年人群,起病隐匿的神经退行性疾病。随着我国人口老龄化加剧,AD患病人数已居世界首位,已成为我国面临的严峻社会问题。AD病理机制复杂,Aβ引起的神经炎症是AD患者大脑的早期病理之一,同时也是Aβ-Tau级联反应的驱动因素。NLRP3炎症小体作为一种炎性传感器复合蛋白,已被证明在AD发病过程中起重要作用 (Nature, 2019), 但Aβ如何介导NLRP3炎症小体激活的机制并不明确。
在本研究论文中,研究人员发现Aβ寡聚体能够通过选择性激活Kv2.1通道诱导小胶质细胞钾外流从而激活JNK/NF-κB通路,并促进NLRP3炎症小体的启动和组装过程。进一步地,研究者以实验室前期从“老药库”中发现的Kv2.1抑制剂Dfe为探针探究了Kv2.1在AD病理中的调控机制。Dfe能够通过抑制Kv2.1通道有效拮抗Aβ寡聚体诱导的小胶质细胞NLRP3炎症小体激活和神经元Tau过度磷酸化,并最终改善AD转基因鼠的病理表型。研究阐述了Aβ介导的NLRP3炎症小体激活的潜在机制,并强调了Kv2.1抑制剂在阻断Aβ-Tau级联反应和治疗AD方面的潜力,为AD的病理机制研究以及基于Dfe的抗AD药物研发提供了重要的科学依据。
青年教师卢健、周谦及朱丹阳为论文的第一作者,王佳颖副教授、曹鹏教授和沈旭教授为本文通讯作者。该研究得到国家自然科学基金、国家重点研发计划和江苏省自然科学基金等项目资助。
论文链接:Drofenine as a Kv2.1 inhibitor alleviated AD-like pathology in mice through Aβ/Kv2.1/microglial NLRP3/neuronal Tau axis https://www.sciencedirect.com/science/article/pii/S221138352400443X
(撰稿人:卢健;审核人:沈旭)
